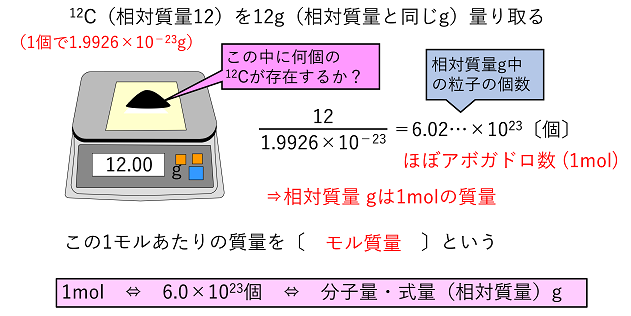
なお、放射性物質の ベクレル数から質量を求める式 を一般的に書くと、 次のようになる。「質量数」とは、物質の質量という意味ではなく、上のセ シウム137なら137のこと。その核種(=原子核の種類)における、陽子 と中性子の個数の和だ。化学:相対質量の求め方 オンライン無料塾「ターンナップ」 対象 高校生 再生時間 303 説明文・要約 ・相対質量の求め方は、実際の質量(絶対質量)を用いて、以下の比の計算をする ・「ある原子の絶対質量」:「質量数12の炭素原子の 単位格子中の原子の質量の求め方がなぜ線を引いたところのようになるかわかりません。 教えてください🙇♀️🙇♀️🙇♀️ 鉄が体心立方博子の結昌構造とるとき、 単位格子の 一辺の長さは, 29 x 10*cm である。
質量と比重
物質の質量の求め方
物質の質量の求め方- 「モル質量」と「原子量、分子量、式量」の違いとは? 化学基礎 1 相対質量とは何か?求め方は?原子量との違いをまとめてみた 化学基礎 116 イオン化エネルギーとは?お金に例えたら大小関係が一瞬でわかった質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 (1)




中2化学 銅の酸化 計算問題 Hiromaru Note
物質移動係数(1)ー物質移動係数の定義d 流速U 物質移動係数k cはJ A = k c (C 1 –C 2)で定義される。 濃度境界層厚みが非常に薄ければ、境界層内の濃度 分布は直線と近似できる。このときモル流束は 界面濃度C 1 mol/m3 濃度C 2 mol/m3 モル流束J A mol/(m2s) その他(学問・教育) 物質の質量の求め方(計算式?) 物質の質量が25(g)だとして、 それに含有されているもの05(wt%)という時、 含有されている物質の質量は 単純に25 x 05 質モル質量は、原子量、分子量などの数字に単位( g/mol )をつけたものと等しい。 例題2 二酸化炭素(CO 2 )1モルは何gか、またその分子1個は何gか。 <解>4401g <答> 3容量モル濃度 定義・説明 容量モル濃度 溶液1000 ml 中に含まれる溶質の物質量( mol )を
気体の体積から物質量・質量を求める 標準状態、つまり温度0℃、圧力1.01×10 5 Paの気体の体積から、その物質量と質量を求めてみます。 標準 物質 の 質量 の 求め 方相対質量や物質量は「質量数12の炭素原子 12 C」が基準となっていたので,これを例にとって物質量〔mol〕と質量〔g〕の関係を考えていきます。 物質量の定義は,「質量数12の炭素原子 12 Cを12g集めたときに存在している原子の数を 質量パーセント濃度の求め方を「溶質」と「溶媒」だけで表すと?? 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だったよね?? 基本的にはこの形なんだけど、たまに、
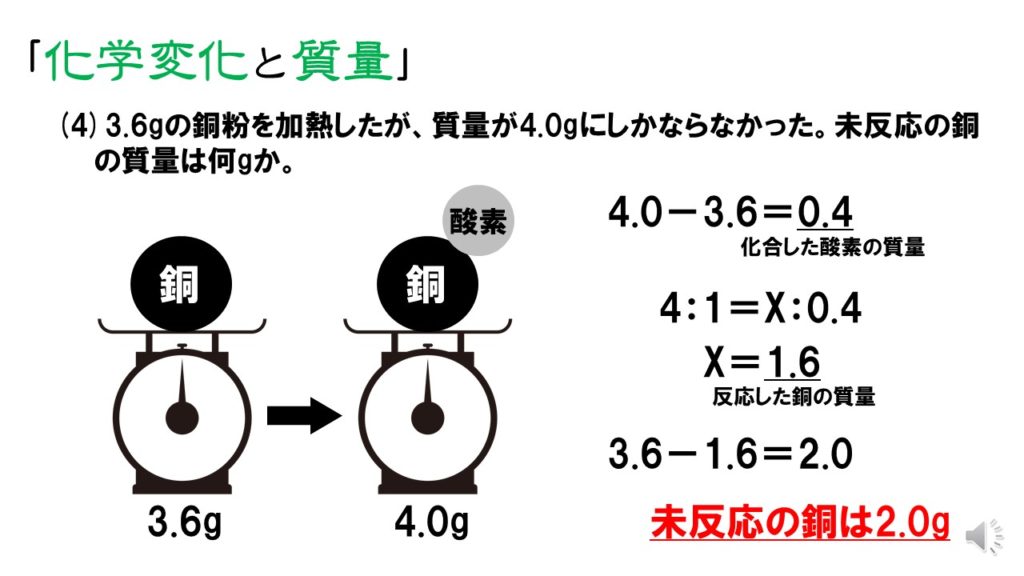
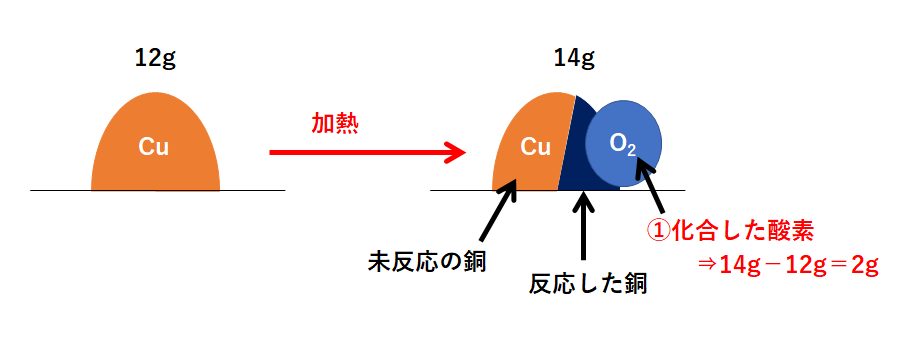
未反応の銅の質量の求め方! 質量の増加分から化合した酸素の質量を求める。 040g-045g=005g 化合した酸素の質量から反応した銅の質量を求める。 4:1=x:005 x=0g 銅全体の質量から反応した銅の質量を引いて未反応の銅の質量を求める。 35 × 76 100 37 × 24 100 ≒ 355 となります。 計算は、以下のように工夫して行うと楽に解けます。 35 × 76 100 37 × 24 100 = 35 × 76 100 ( 35 2) × 24 100 = 35 × 76 100 35 × 24 100 2 × 24 100 = 35 × 76 24 100 2 × 24 100 = 密度の出し方は次の公式で計算できちゃうよ。 密度 = 質量 ÷ 体積




物質量molの超解説 理系ラボ
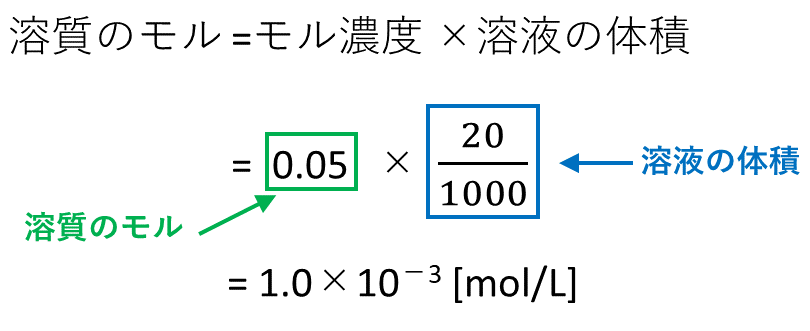



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する
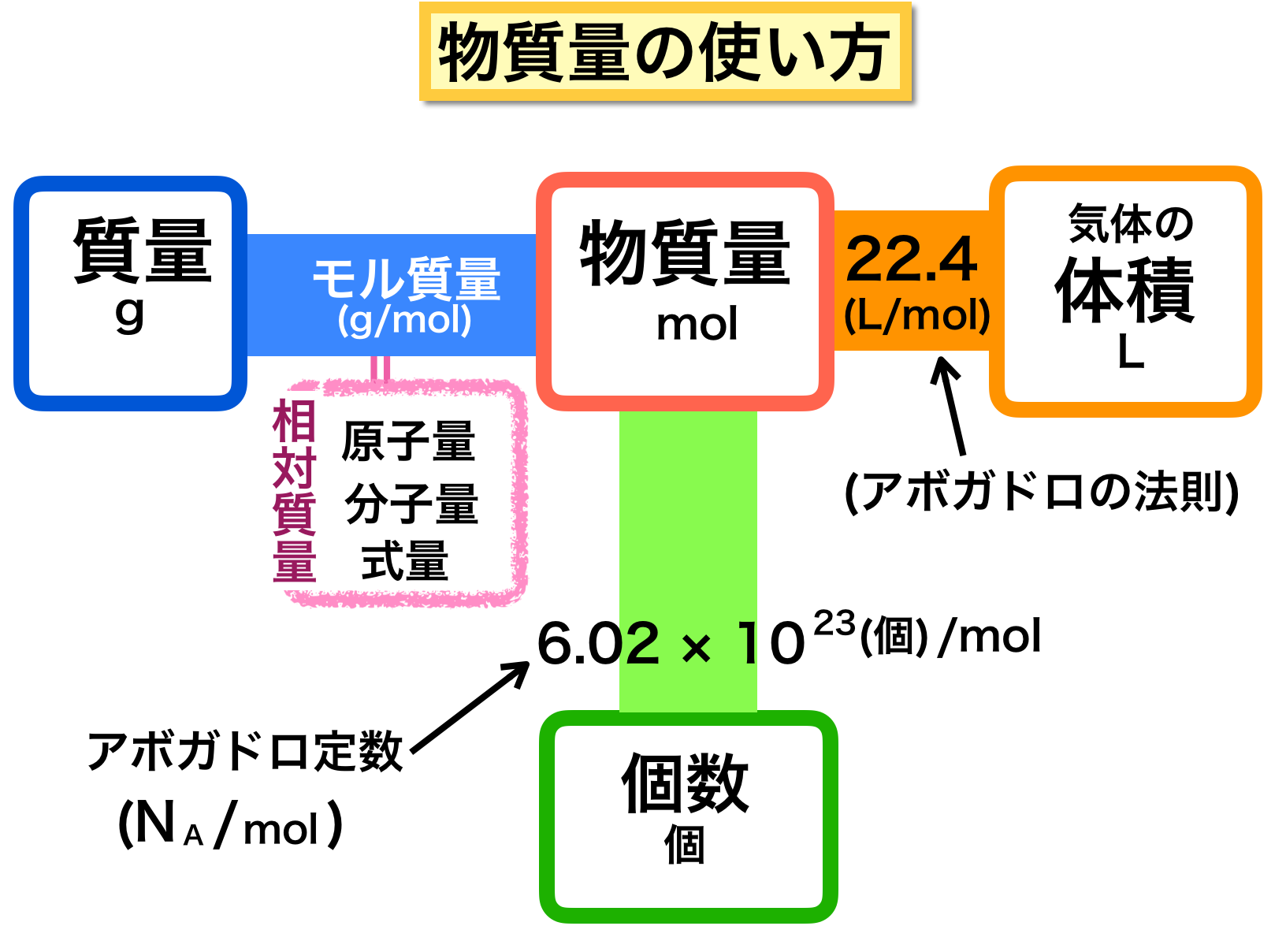
1mol (今ある水素の物質量):x mol(必要な酸素の物質量) = 2mol(水素の物質量) :1mol(酸素の物質量) 2x = 1 →x = 1÷2 = 05 mol× mol = g より,モル質量〔g/mol〕に物質量〔mol〕を掛けることで,質量〔g〕を求めることができます( w = n × M )。 g ÷ = mol より,質量〔g〕をモル質量〔g/mol〕で割ることによって,物質量〔mol〕を求めることができます( n = )。 物質の質量はモル質量に物質量をかければ求まる比例関係にあるのでむずかしくありません。 (物質の質量)=(モル質量)×(物質量) ・・・① または (物質量)=(物質の質量)÷(モル質量) ・・・② となります。
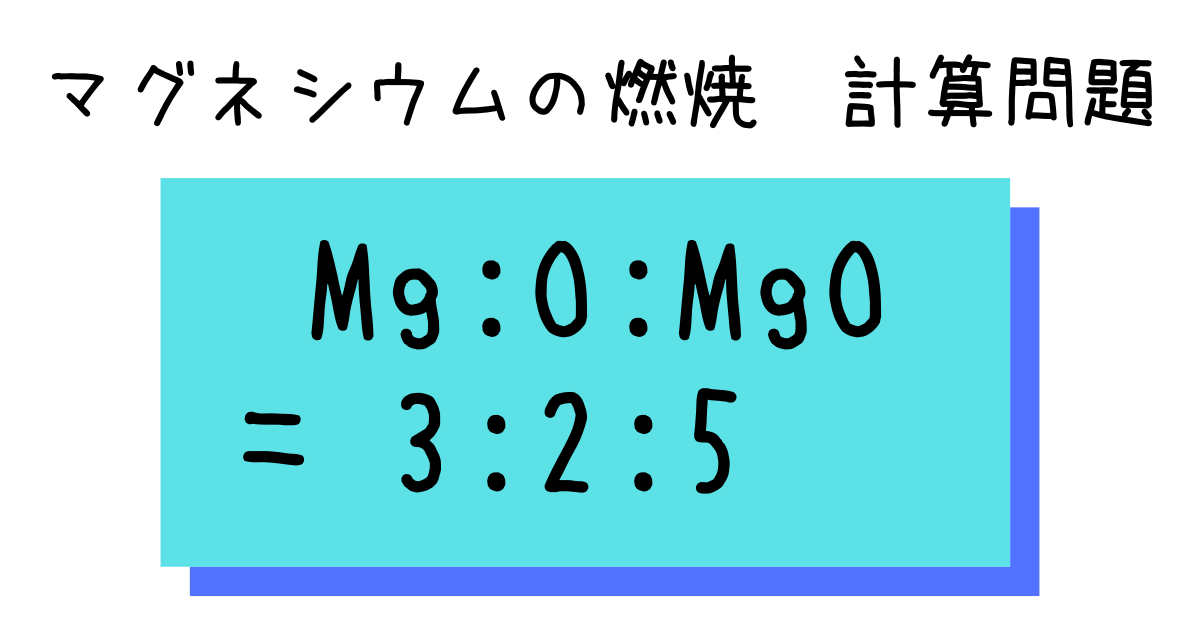



中2化学 マグネシウムの燃焼 計算問題 Hiromaru Note




高校化学基礎 モル質量とは 映像授業のtry It トライイット
溶質の質量を求める 水溶液の濃度の応用問題では、いつも真っ先に 「溶質は何gとけているだろう?」 「水溶液全体の質量は何gだろう?」 の2つを考えることができれば大丈夫です。Tap to unmute If playback doesn't begin shortly, try restarting your device You're signed out Videos you watch may be added to the TV's watch history 物質量は、次の式で計算できます。 物質量 mol = 質量 g / 分子量 たとえば、36gの水の物質量は 36g/18=2mol というふうに求められ、2molであるとわかります。




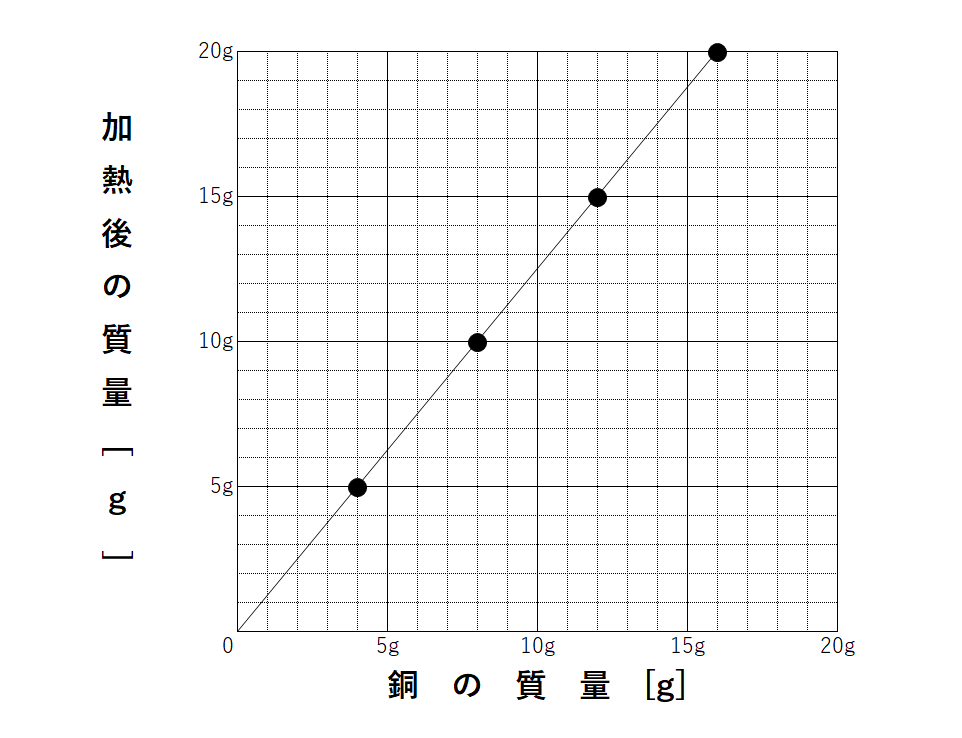
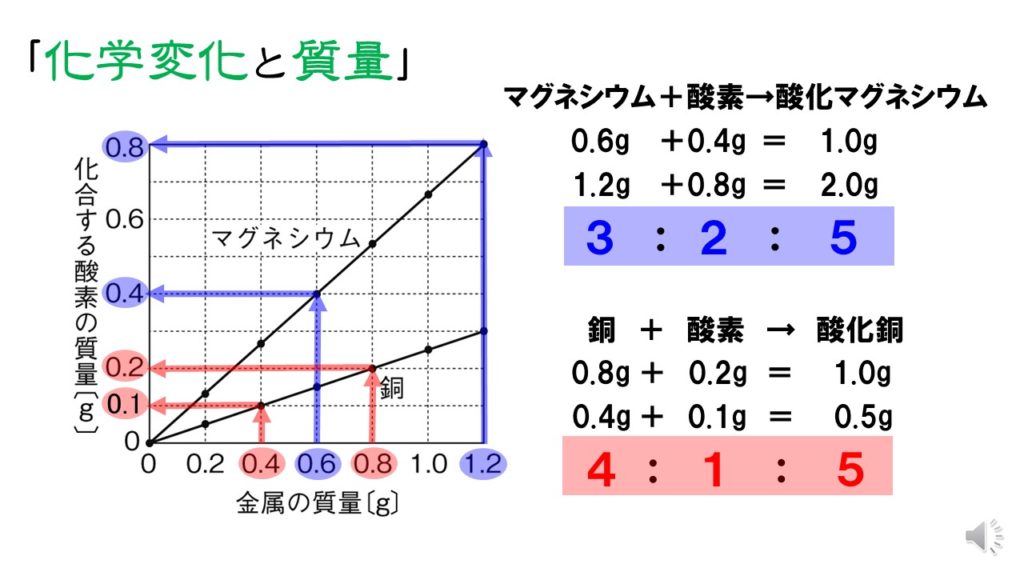
Akiya Su Auf Twitter 理科 化合と質量 化学変化をする物質の質量比が等しいことを利用するして 化合物の質量を求める まず数学の比の方程式から これができないと質量比の問題は解けません 中学理科 中学数学 方程式 比 化合 酸化 燃焼




中2 理科 中2 12 化合する物質の割合 基本編 Youtube
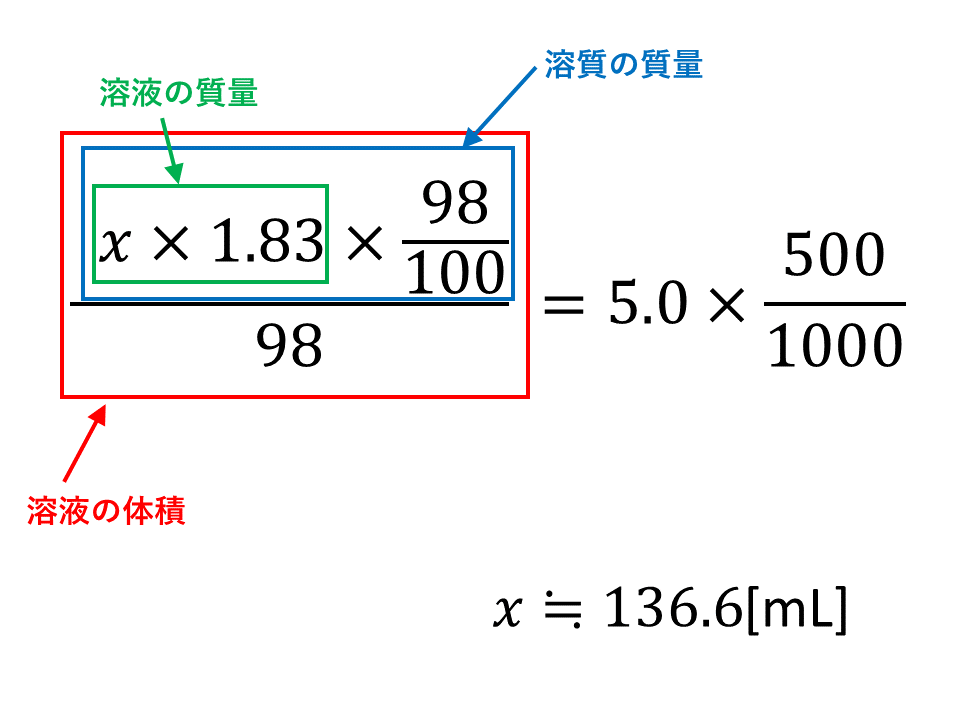
(2) 溶質の物質量(mol)から質量(g)を求めましょう。 塩化水素の分子量は 10 355 = 365 ということは塩化水素は 1mol で 365g ということより、 12mol では365 × 12 = 438(g) (3) 溶液の体積(L)から質量(g)を求めましょう。 密度 118g/cm 3 から溶液 1L の質量(g)は STEP2 片方の分子の存在比をxとし、STEP1で求めた値と各分子の分子量を使って物質量比を求める 次に、片方の分子(今回はCO 2 )の存在比をxとし、STEP1で求めた混合気体の見かけ上の分子量と各分子の分子量を使って物質量比を求める。 44 ( g / m o l) × x 32この物体の体積を求めなさい。 密度=質量÷体積 の公式に当てはめると、 ←1355=6775÷χ 求めたいところをχとしているよ。 χ =6775÷1355=500(cm3) 別な考え方 密度は ← この「1cm3(1cm×1cm×1cm)」の体積で何g か、ということを




物質量 Mol とモル質量と原子量の関係




原子量 分子量 式量の違いと モル質量の計算での求め方 使い方をわかりやすく解説
「 溶液1l中の溶質の量を物質量で表したもの 」をモル濃度と言います。 モル濃度のモルは物質量の単位のことです。求め方は以下の通りです。 質量パーセント濃度と式の形は似ていますが、 大きな違いはやはり100倍しないことですね。 というのも、



質量と比重




1 物質量を含む計算 2 化学が苦手な人の為のブログ By Uk Crooz Blog




ステンレス皿の質量の求め方をわかりやすく教えてください Clear




中学理科 3分でわかる 密度の求め方 出し方の計算公式 Qikeru 学びを楽しくわかりやすく



溶質を求める




中2理科 化学変化と質量の計算 練習編 映像授業のtry It トライイット




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




化学 原子量の計算方法 オンライン無料塾 ターンナップ




4 6 溶液の濃度 おのれー Note



高1理科の問題です この写真で質量 モル 物質みたいな計算をするときにわかり Yahoo 知恵袋




密度 体積 質量の換算式と求め方 計算問題 モッカイ




中2化学 原子1個の質量 中学理科 ポイントまとめと整理



Www Fureai Cloud Jp Tomisatokita J Attach Get2 263 0
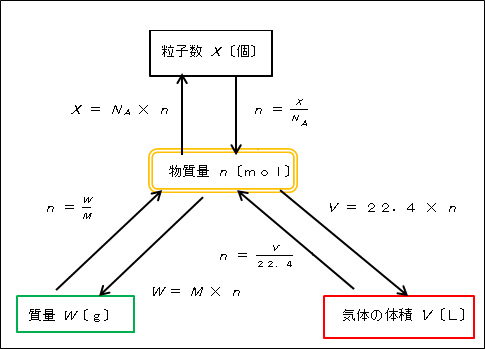



物質量 の指導における イメージ化 化学授業実践記録 アーカイブ一覧 理科 高等学校 知が啓く 教科書の啓林館



3




物質 気体 水溶液 密度はどのように求めるのか 中学理科 定期テスト対策サイト
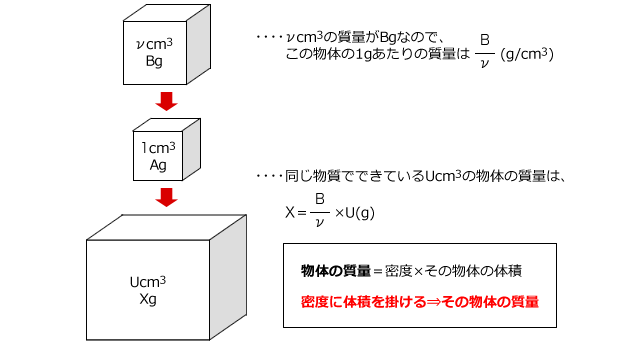



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月



中2理科 化学変化と質量 銅とマグネシウムの計算 Pikuu




いろいろな物質と密度 無料で使える中学学習プリント




中学理科 3分でわかる 密度の求め方 出し方の計算公式 Qikeru 学びを楽しくわかりやすく




分子量とは 単位もわかる 高校化学で必見の計算方法とは 高校生向け受験応援メディア 受験のミカタ




モル質量の求めかた教えてください Clear



密度と体積の関係は 1分でわかる意味 違い 計算と覚え方 質量との関係




物質量とモル質量の違いや アボガドロ定数をわかりやすく解説



中2化学 定比例の法則 酸化 中学理科 ポイントまとめと整理



Q Tbn And9gct5ugrju6fgyyg3ivuopnykcprqdb915pbi5iylny2zus3hrklx Usqp Cau




高校化学基礎 相対質量の計算 映像授業のtry It トライイット



質量の求め方は 1分でわかる公式と求め方 体積 密度との関係 求め方




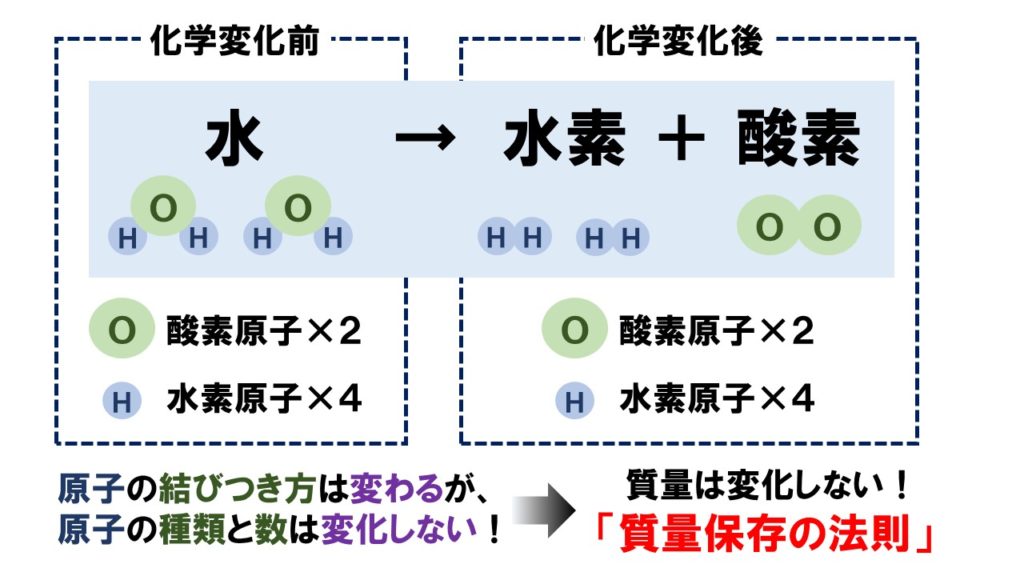
質量保存の法則を使った計算問題 塾の質問箱




中2 理科 中2 11 化学変化と質量の変化 Youtube




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




高校化学基礎 モル質量の計算 練習編 映像授業のtry It トライイット




質量保存の法則の計算問題 加熱が不十分だったとき 塾の質問箱




中2化学 銅の酸化 計算問題 Hiromaru Note



中2化学 定比例の法則 未反応 混合物 中学理科 ポイントまとめと整理




中2 理科 中2 13 化合する物質の割合 計算編 Youtube




中2 理科 2 旧 銅とマグネシウムの計算問題 Youtube




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Relative Mass




問題 マグネシウム原子1個の質量を求めよ Clear




物質量molの超解説 理系ラボ




2 の未反応の銅粉末の質量の求め方を教えて頂きたいです 答えは0 52gです Clear




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



中2理科 化学変化と質量 銅とマグネシウムの計算 Pikuu




中学理科 還元されずに残った酸化銅の質量 の求め方 なるほどの素



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




物質量の求め方とは 単位や計算問題も解説 高校生向け受験応援メディア 受験のミカタ



大気の平均分子量と物質量 Mol のまとめ 色と形で気象予報士




質量や原子数分子数と物質量 Mol を変換する計算問題



物質量



中2理科 質量保存の法則のポイント Examee




高校化学基礎 モル質量の計算 練習編 映像授業のtry It トライイット




中1理科 密度の計算 3パターンの計算方法 Pikuu




化学 質量数と相対質量 オンライン無料塾 ターンナップ




物質量 Mol とモル質量と原子量の関係




化学基礎 物質の変化07 モル質量の求め方 13分 Youtube




これでできる モル Mol 計算 化学基礎 最大の難所を突破しよう 化学 アイドル好きのホームページ




4 6 溶液の濃度 おのれー Note




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




密度の公式 求め方 しみた の法則 無料プリント 中学理科 Yattoke 無料プリント



炭素 原子量 分子量を知って物質量を求めよう 誰でもわかる分子量から物質量の求め方 オススメ参考書も Amp Petmd Com




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ




化学基礎 基本の物質量 Mol 計算について Study By Tmt




Akiya Su Auf Twitter 理科 化合と質量 化学変化をする物質の質量比が等しいことを利用するして 化合物の質量を求める まず数学の比の方程式から これができないと質量比の問題は解けません 中学理科 中学数学 方程式 比 化合 酸化 燃焼




分子1個の質量の求め方は なぜこのようになるのでしょうか 初歩的な質問ですみません Clear
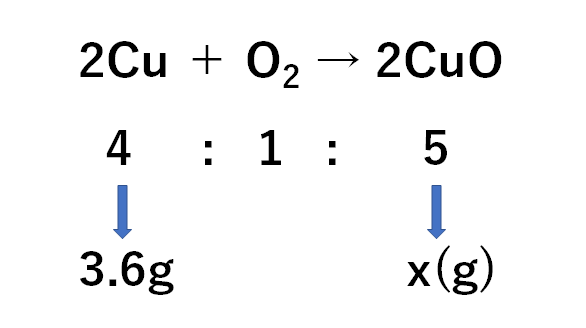



中2化学 定比例の法則 酸化 中学理科 ポイントまとめと整理
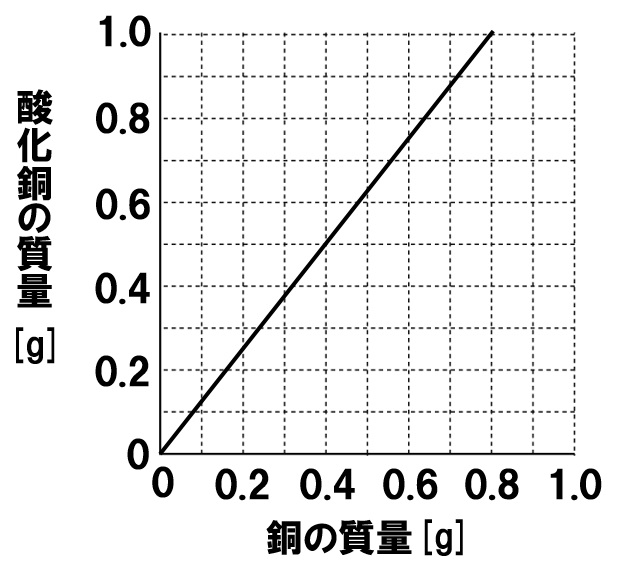



中2理科 化学変化と質量の計算問題 Examee
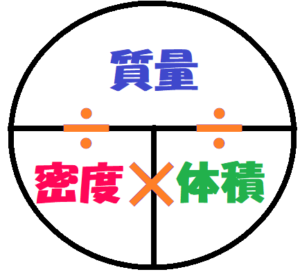



中学校理科の公式一覧




密度の公式 物質の密度の求め方は しみた の法則 中学理科 Yattoke 小 中学生の学習サイト
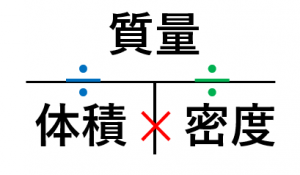



質量 密度 体積それぞれの求め方 具体例で学ぶ数学




水の質量と体積を変換 換算 する方法 計算問題を解いてみよう 水の重さの求め方




物質量とモル質量の違いは 計算問題を解いてみよう 演習問題




中学理科 還元されずに残った酸化銅の質量 の求め方 なるほどの素




溶液の性質 水和水をもつ固体の溶解度の求め方を教えてください 化学 定期テスト対策サイト



質量の求め方を教えてください 問題には 密度3 6g であり 体積 Yahoo 知恵袋
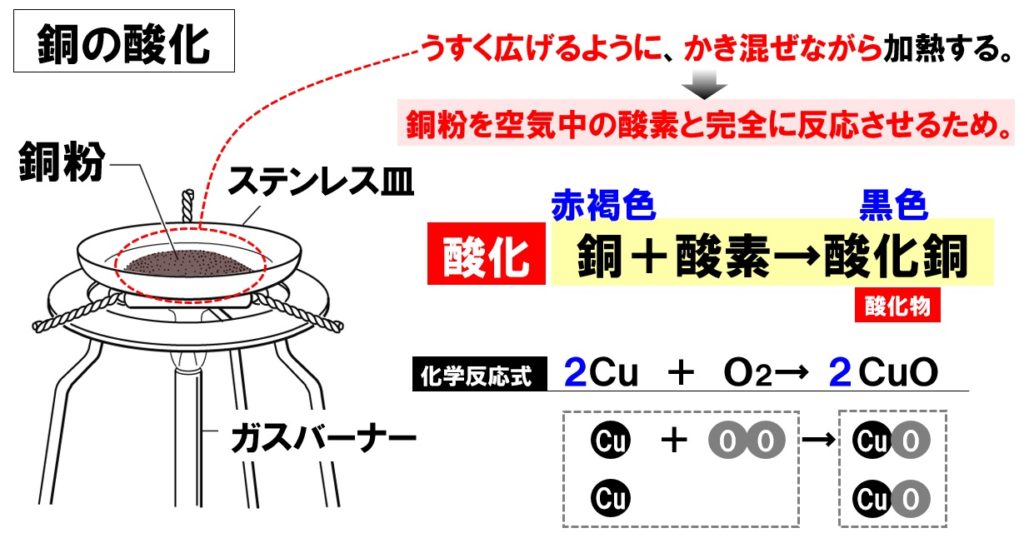



中2理科 化学変化と質量の計算問題 Examee




高校化学 質量と物質量 相対質量の求め方 オンライン無料塾 ターンナップ Youtube



質量の求め方は 1分でわかる公式と求め方 体積 密度との関係 求め方
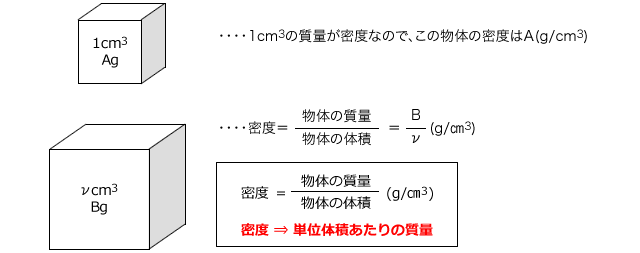



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
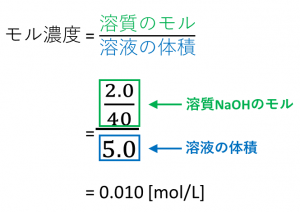



質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
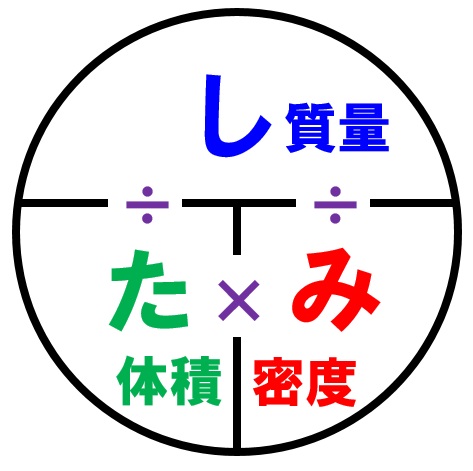



中1理科 密度の求め方3パターンの計算方法 Examee
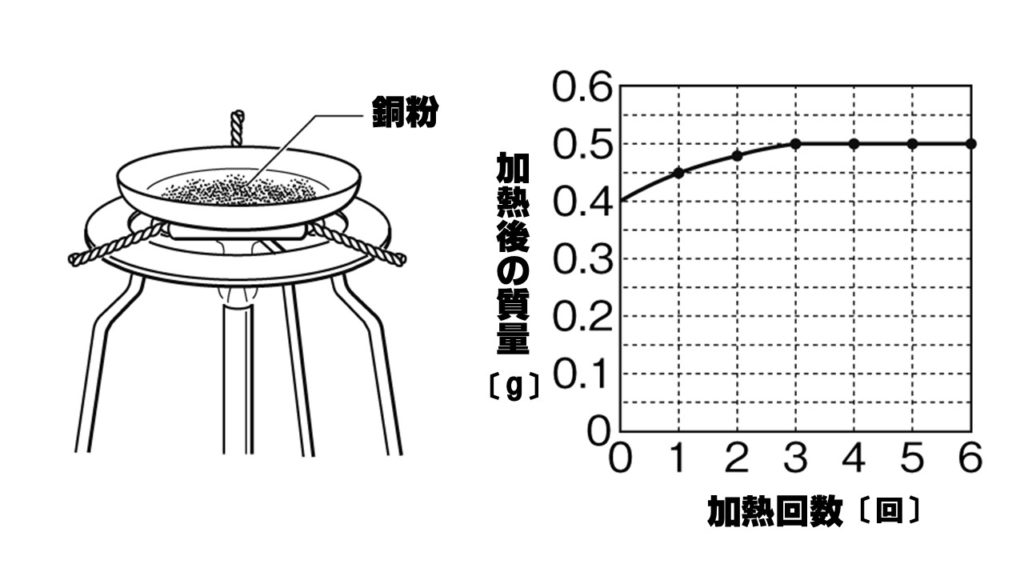



中2理科 化学変化と質量の計算問題 Examee



Q Tbn And9gct5ugrju6fgyyg3ivuopnykcprqdb915pbi5iylny2zus3hrklx Usqp Cau




質量パーセント濃度の求め方とモル濃度の違い




高校化学 相対質量 写真のように12cを12として 1hの相対質量を求め Okwave




原子量とは 求め方や単位も見やすい図と例で即理解 分子量との違いも 高校生向け受験応援メディア 受験のミカタ



3




質量パーセント濃度の計算問題集 基本編 Menon Network




エ で酸化せずに残ったマグネシウムの質量の求め方を教えてください Clear




メタンの分子式と構造式は メタンの質量と密度 G Cm3 や分子量の計算方法 1立方メートルの重さ モッカイ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
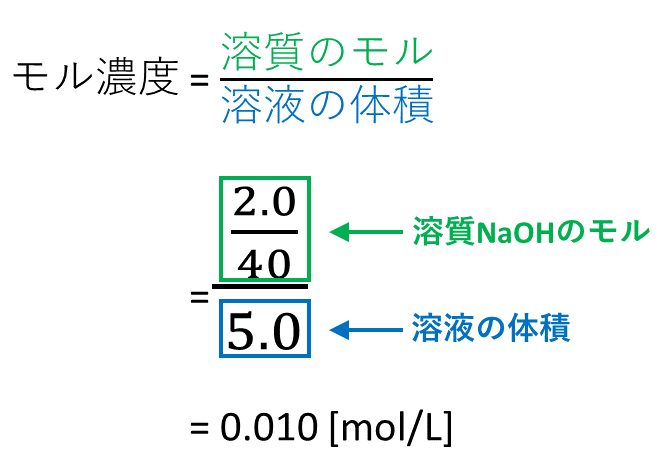



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



0 件のコメント:
コメントを投稿